Neste experimento poderemos observar na prática conceitos como interações ou forças intermoleculares, tensão superficial de forma bem divertida!
Lista de materiais
* Detergente (de preferência neutro);
* Água;
* Xarope de glucose de milho (pode ser encontrado como Karo em supermercados) ;
* Mangueira ou bambolê ou podemos fazer um equipamento bem simples usando corda e espetos de churrasco;
* Bacia plástica bem grande.
Procedimento Experimental:
- Coloque no recipiente os 300 mL de água e 100 mL de xarope de milho e misture bem
- Adicione 200 mL de detergente e misture suavemente para evitar a formação de bolhas. Sempre siga essa mesma proporção (3-2-1).
- Deixe essa mistura descansar por dois dias.
Resultados e Discussão:
Bem, você já tentou fazer uma bolha somente com água? Isso não é possível porque as moléculas de água interagem umas com as outras com uma força intermolecular muito forte, a ligação de hidrogênio. O oxigênio de uma molécula de H2O é atraído pelo hidrogênio de outra molécula de água. Assim, é muito difícil separar essas moléculas para formar uma bolha.
As moléculas que se situam na superfície da água exercem essa atração apenas com moléculas abaixo e ao lado delas, pois não existem moléculas na parte de cima. Isso origina a chamada tensão superficial, que é uma fina camada sobre a superfície da água.
A fim de diminuir essa superfície ao mínimo e ficar mais estável, a bolha adquire o formato esférico, com menor área de superfície e volume.
Quando adicionamos o detergente, ele diminui a tensão superficial da água, por isso é chamado de agente tensoativo ou surfactante. As moléculas do detergente interagem com as moléculas de água que restaram, separando-as e mantendo a bolha. No entanto, com o passar do tempo, a água da bolha vai evaporando até que ela estoure.
Para impedir que isso ocorra com tanta facilidade, adicionamos o xarope de milho, que é a nossa “arma secreta” nesse experimento. O xarope de milho é formado por 80% de glicose e 20% de frutose, que são monossacarídeos ou oses. Essas substâncias possuem em sua estrutura vários grupos hidroxila (OH), conforme mostra a figura a seguir:
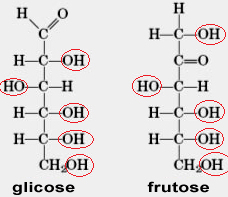
Estruturas da glicose e da frutose com grupos hidroxila em destaque.
As moléculas com vários grupos hidroxila podem realizar ligações de hidrogênio com as moléculas de água. Essas fortes interações com a água dificultam a sua evaporação e propiciam bolhas enormes e mais resistentes.
Explicação feita por: Jennifer Fogaça
em:
http://manualdaquimica.uol.com.br/experimentos-quimica/bolhas-sabao-gigantes.htm
#bolhasdesabao #experimentos #experiencias #laboratorio #escola #feiradeciencias #ciencia #professor #escola #quimica #biologia #fisica #diversao
#bolhasdesabao #experimentos #experiencias #laboratorio #escola #feiradeciencias #ciencia #professor #escola #quimica #biologia #fisica #diversao

Nenhum comentário:
Postar um comentário